Was ist eine Durchbruchsinfektion? Die CDC definieren eine Durchbruchsinfektion als "Infektion einer vollständig geimpften Person". Die wichtigste Erkenntnis dabei ist nach wie vor, dass Menschen mit Durchbruchsinfektionen im Gegensatz zu ungeimpften Personen weitaus seltener an schweren COVID-19-Symptomen leiden; was für die Wirksamkeit einer Impfung spricht.
Systemische und mukosale Immunität
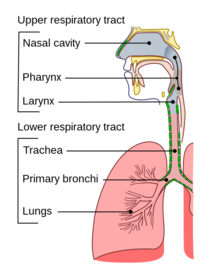
Warum kommt es zu Durchbruchsinfektionen? COVID-19 ist eine Krankheit, die die unteren Atemwege (Luftröhre, primäre Bronchien und Lungen) befällt. Die derzeit zugelassenen Impfstoffe, die durch intramuskuläre Injektion verabreicht werden, bewirken eine systemische Immunreaktion (die hauptsächlich durch Immunglobulin G oder IgG vermittelt wird), die das Virus in der Lunge neutralisiert. Der Eintrittspunkt für SARS-CoV-2 ist jedoch der obere Respirationstrakt (Nasenhöhle, Mund und Rachen).
Eine starke systemische Immunreaktion nach einer intramuskulären Impfung geht nicht unbedingt mit einer starken Immunreaktion der Schleimhäute (die hauptsächlich durch IgA vermittelt wird) in den oberen Atemwegen einher (1). Daher können geimpfte Personen immer noch positive Ergebnisse bei SARS-CoV-2-PCR-Tests aufweisen – bei denen in der Regel Nasen- oder Nasen-Rachen-Abstriche zur Probenentnahme verwendet werden –, weil das Virus in den oberen Atemwegen in nachweisbaren Mengen vorhanden sein kann. Frühere Studien haben gezeigt, dass die Inzidenz von Durchbruchsinfektionen bei vollständig geimpften Personen äußerst niedrig ist (2,3). Eine neuere Studie der Universität Wisconsin-Madison und ihrer Mitarbeitenden zeigte jedoch, dass vollständig geimpfte Personen, die mit der Delta-Variante infiziert sind – die infektiöser ist als das ursprüngliche Virus –, ähnliche Mengen des Virus "ausscheiden" wie ungeimpfte Personen (4).
In einem früheren Beitrag [Anmerkung der Redaktion: des Blogs Promega Connection] wurde der Unterschied zwischen systemischer und mukosaler Immunität erörtert, worüber bereits ausführlich berichtet wurde (5,6). In dem Blogbeitrag wurde eine mögliche Lösung vorgeschlagen, um das Virus an der Infektionsquelle zu stoppen: intranasale SARS-CoV-2-Impfstoffe. In einem im Juli 2021 veröffentlichten Artikel in Science heißt es: "Es scheint überraschend, dass nur sieben der fast hundert SARS-CoV-2-Impfstoffe, die derzeit in klinischen Studien getestet werden, intranasal verabreicht werden." (7). Die Autoren geben einen Überblick über den aktuellen Stand der Forschung zu intranasalen Impfstoffen und argumentieren für deren Vorteile gegenüber der intramuskulären Injektion, sowohl bei der Bekämpfung der SARS-CoV-2-Infektion an der Quelle als auch bei der Verringerung der Virusausscheidung, die die Krankheit verbreiten kann.
Intranasale Impfstoffentwicklung
Intranasale Impfstoffe bieten weitere Vorteile gegenüber den derzeitigen mRNA-Impfstoffen. Sie sind einfacher zu verabreichen und werden möglicherweise besser akzeptiert als intramuskuläre Injektionen. Sie müssen nicht lange tiefgekühlt gelagert werden und eignen sich besonders für die Massenverteilung in Ländern, in denen ein großer Teil der Bevölkerung ungeimpft bleibt. Die Entwicklung intranasaler Impfstoffe steht jedoch vor einigen Herausforderungen.
Die lipidgekapselten mRNA-Impfstoffe sind nicht für die intranasale Verabreichung geeignet (7). Jeder intranasale Impfstoff muss die Barriere überwinden, die der Nasenschleim darstellt, damit das Antigen wirksam an die Nasenepithelzellen abgegeben werden kann. Bei den meisten intranasalen SARS-CoV-2-Impfstoffen, die sich derzeit in der klinischen Erprobung befinden, handelt es sich entweder um adenovirale Vektorimpfstoffe oder um Impfstoffe aus abgeschwächten Lebendviren. Ihre Sicherheit und Wirksamkeit müssen noch abschließend nachgewiesen werden. Die Ergebnisse ausgewählter präklinischer Studien, die verschiedene Ansätze zur Entwicklung intranasaler Impfstoffe illustrieren, werden hier zusammengefasst.
- An et al. verwendeten einen neuartigen Ansatz, bei dem lyophilisiertes SARS-CoV-2-Spike-Protein und ein Agonist der zyklischen GMP-AMP-Synthase und des STING-Signalwegs (Stimulator des Interferon-Gens) als Adjuvant eingesetzt wurden (8). Der STING-Agonist wurde in liposomale Nanopartikel eingekapselt, um die Effizienz der Impfstoffabgabe zu erhöhen. Der Impfstoff löste bei Mäusen nach intranasaler Verabreichung sowohl eine Schleimhaut- als auch eine systemische Immunität aus. Der Impfstoff wird derzeit von AuraVax Therapeutics vermarktet.
- Der Adenovirus-Vektor-Impfstoff für Schimpansen, ChAdOx1 nCoV-19, wurde von der Universität Oxford und AstraZeneca entwickelt und ist derzeit für die intramuskuläre Injektion zugelassen. In einer neuen Studie wurde der Impfstoff Makaken und Hamstern intranasal verabreicht, gefolgt von einer Infektion mit einem mutierten SARS-CoV-2-Stamm (9). Bei beiden Tieren ging die Viruslast in Nasenabstrichen im Vergleich zu Kontrollgruppen zurück und wurde im Gewebe der unteren Atemwege reduziert oder eliminiert.
- In einem anderen viralen Vektoransatz verwendeten Ohtsuka et al. einen replikationsinkompetenten humanen Parainfluenzavirus-Typ 2-Vektor (hPIV2-Vektor), der ein präfusionsstabilisiertes Spike-Protein (S-2PM) sowie mehrere andere Mutanten exprimiert (10). Die intranasale Impfung von Mäusen mit einem Impfstoff auf S-2PM-Basis induzierte die Bildung von neutralisierenden IgG- und IgA-Antikörpern. Die intranasale Impfung von Hamstern mit einer Einzeldosis bot einen vollständigen Schutz gegen SARS-CoV-2 in der Lunge, und eine Auffrischung zwei Wochen vor der viralen Herausforderung führte zu einem praktisch vollständigen Schutz in den Nasengängen. Ähnliche Ergebnisse erzielten Park et al. mit einem Newcastle-Disease-Virus-Vektor (NDV-Vektor), der das Spike-Protein exprimiert (11).
- In einer Studie von Meissa Vaccines wurde ein lebendes rekombinantes humanes Respiratorisches Synzytial-Virus (RSV) verwendet, das ein chimäres SARS-CoV-2-Spike-Protein exprimiert (12). Eine einzige intranasale Dosis bei afrikanischen grünen Affen erzeugte sowohl eine mukosale als auch eine systemische Immunität gegen das homologe SARS-CoV-2 sowie die Alpha- und Beta-Varianten. Darüber hinaus verringerte der Impfstoff die Virusausscheidung in der Nase nach einer viralen Infektion um mehr als das 200-fache. Der Impfstoff befindet sich derzeit in Phase 1 der klinischen Studien.
Der aktuelle Stand der Entwicklung intranasaler Impfstoffe wurde von Chavda et al. (13) umfassend dargestellt. Weitere Informationen über die noch laufenden klinischen Studien zu intranasalen SARS-CoV-2-Impfstoffen finden Sie unter clinicaltrials.gov.
Was ist der nächste Schritt?
Vorläufige klinische Studiendaten des intranasalen, mit Adenoviren geimpften Impfstoffs von CanSino Biologics zeigten vielversprechende Ergebnisse. Zwei intranasale Dosen lösten eine ähnliche neutralisierende Antikörperreaktion aus wie eine intramuskuläre Dosis (14). Bharat Biotech (Indien) arbeitet ebenfalls an einem intranasalen Impfstoff mit Adenovirus-Vektor in klinischen Studien. Mit weiteren Erkenntnissen aus klinischen Studien dürften wir ein genaueres Bild von der Wirksamkeit und Sicherheit intranasaler Impfstoffe erhalten, insbesondere im Hinblick auf die Eindämmung von Durchbruchsinfektionen. Letztendlich besteht die Möglichkeit, dass eine intramuskuläre Injektion, gefolgt von einer intranasalen Auffrischung, die stärkste Wirkung hervorruft (7). In der Zwischenzeit bleibt eine Kombination aus den derzeitigen Impfungen und Maßnahmen zur Eindämmung der Infektion, wie z. B. die Verwendung von Masken, die beste Schutzmaßnahme.
Quellen:
- Wisnewski, A.V. et al. (2021) Human IgG and IgA responses to COVID-19 mRNA vaccines. PLoS ONE 16(6), e0249499.
- Thompson, M.G. et al. (2021) Interim estimates of vaccine effectiveness of BNT162b2 and mRNA-1273 COVID-19 vaccines in preventing SARS-CoV-2 infection among health care personnel, first responders, and other essential and frontline workers—Eight U.S. locations, December 2020–March 2021. MMWR Morb. Mortal. Wkly. Rep. 70(13), 495–500.
- Keehner, J. et al. (2021) SARS-CoV-2 infection after vaccination in health care workers in California. N. Engl. J. Med. 384, 18.
- Riemersma, K.K. et al. (2021) Shedding of infectious SARS-CoV-2 despite vaccination. [medRxiv preprint] https://doi.org/10.1101/2021.07.31.21261387
- Russell, M.W. et al. (2020) Mucosal immunity in COVID-19: A neglected but critical aspect of SARS-CoV-2 infection. Front. Immunol. 11, 611337.
- Ratcliffe, N.A. (2021) Nasal therapy—The missing link in optimizing strategies to improve prevention and treatment of COVID-19. PLoS Pathog. 17(11), e1010079.
- Lund, F.E. and Randall, T.D. (2021) Scent of a vaccine: Intranasal vaccination should block SARS-CoV-2 transmission at the source. Science 373(6553), 397–399.
- An, X. et al. (2021) Single-dose intranasal vaccination elicits systemic and mucosal immunity against SARS-CoV-2. iScience 24, 103037.
- van Doremalen, N. et al. (2021) Intranasal ChAdOx1 nCoV-19/AZD1222 vaccination reduces viral shedding after SARS-CoV-2 D614G challenge in preclinical models. Sci. Transl. Med. 13, eabh0755.
- Ohtsuka, J. et al. (2021) Non-propagative human parainfluenza virus type 2 nasal vaccine robustly protects the upper and lower airways against SARS-CoV-2. iScience, 2021, 103379.
- Park, J.-G. et al. (2021) Immunogenicity and protective efficacy of an intranasal live-attenuated vaccine against SARS-CoV-2. iScience 24, 102941.
- Tioni, M.F. (2021) One mucosal administration of a live attenuated recombinant COVID-19 vaccine protects nonhuman primates from SARS-CoV-2. [bioRxiv preprint] https://doi.org/10.1101/2021.07.16.452733
- Chavda, V.P. et al. (2021) Intranasal vaccines for SARS-CoV-2: From challenges to potential in COVID-19 management. Drug Discov. 26(11), 2619–2636.
- Wu, S. et al. (2021) Safety, tolerability, and immunogenicity of an aerosolized adenovirus type-5 vector-based COVID-19 vaccine (Ad5-nCoV) in adults: preliminary report of an open-label and randomised phase 1 clinical trial. Lancet Infect. Dis. 21, 1654–1664.